ex.:
M(CuSO4)
= M(Cu) + M(S) + 4 M(O)
= 63,5
+ 32,1 + (4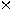 16,0)
16,0)
= 159,6 g.mol-1
La quantité de matière n est le nombre d'entités chimiques présentes dans un échantillon.
L'unité de quantité de matière est la
mole (symbole : mol ).
ex.: |
0,1 mol de sulfate de cuivre - 5 mol d'eau - etc... |
La masse molaire M d'une espèce
chimique est la masse d'une mole de cette espèce ; elle s'exprime généralement
en g.mol -1 .
ex.: |
M(CuSO4) |
= M(Cu) + M(S) + 4 M(O) |
remarque : |
selon le cas, on parlera de masse molaire atomique, moléculaire ou ionique... |
La pesée d'un échantillon permet de connaître sa masse m , généralement exprimée en grammes (symbole : g ).
Connaissant sa masse molaire M , on peut alors déterminer la quantité de matière
n de cet échantillon
:
|
avec |
m en g |
ex.: |
on pèse un bloc de cuivre : |
d'où n = |
remarque : |
le résultat d'un calcul ( |
Connaissant la masse volumique ou la
densité d'une espèce chimique, il suffit de mesurer le volume d'un
échantillon de cette espèce pour déterminer sa masse :
{ |
|
avec |
m en g |
|
Connaissant sa masse molaire M , on peut alors déterminer la quantité de matière
n de cet échantillon :
|
avec |
m en g |
remarque : |
la précision d'une mesure de volume dépend de la verrerie utilisée ; pour un instrument gradué, elle est d'une demi-graduation... |
rappels : |
1 mL = 1 cm3 |
Si la température et la pression ne sont pas trop élevés, les gaz réels peuvent être assimilés à des gaz parfaits.
Dans ce cas, on peut utiliser l'équation d'état
des gaz parfaits pour déterminer la quantité de matière
d'un gaz :
|
|
avec |
p en Pa |
rappels : |
la température absolue s'exprime en kelvin ; on note :
|
Le volume molaire Vm d'un gaz est le volume occupé par une mole de ce gaz :
|
avec |
p en Pa |
ex.: |
à 0°C et sous 1,013.105 Pa ( C.N.T.P. ), on a :
|
Connaissant le volume molaire d'un gaz, on peut déterminer la quantité de matière d'un échantillon de ce gaz :
|
avec |
V en L |
Connaissant la concentration molaire d'une espèce chimique en solution, on peut déterminer la quantité de matière du soluté :
|
|
avec |
n en mol |
ex.: |
on prélève 3,0 mL de
sang pour analyse et on trouve 5,3 mmol.L-1 d'urée :
|
remarque : |
dans l'expression de la concentration molaire, V représente le volume de la solution homogène. |
On rappelle que le titre ou concentration massique (ou teneur
massique) d'une espèce A peut s'exprimer sous la forme :
|
} |
|
avec |
m(A) en g |
|
On peut donc déterminer la quantité de matière
d'un soluté à partir du titre de la solution :
|
avec |
t(A) en g.L-1 |
ex.: |
analyse de sang (3,0 mL prélevés)
: M(urée) = M(CH4N2O) = 60,0 g.mol-1 n(urée) = |