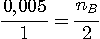ch12 : BILAN DE MATIÈRE
1. Notion d'avancement
Pour caractériser l'état d'un système
chimique au cours d'une transformation, on utilise une grandeur notée
x et exprimée
en moles, qui est appelée avancement .
ex. : |
équation chimique |

|
état initial (en
mol) |
a |
b |
0 |
état intermédiaire
(en mol) |
a - x |
b - x |
x |
état final (en
mol) |
|
|
|
|
L'avancement maximal
de la réaction, noté xmax , est la plus
petite valeur de x
pour laquelle la quantité de matière d'un des réactifs
devient nulle : celui-ci est appelé réactif
limitant ; les autres réactifs sont en excès.
ex. : |
équation chimique |

|
état initial (en
mol) |
0,10 |
0,02 |
0 |
état intermédiaire
(en mol) |
0,10 -
x |
0,02 - x |
x |
état final (en
mol) |
0,08 |
0 |
0,02 |
Quand x = 0,02 mol , il n'y a plus de dioxygène : c'est
le réactif limitant.
La réaction s'arrête
même s'il reste du carbone, qui est ici en excès.
|
On peut également noter :
ex. : |
EI (T,P)
C (s)
: 0,10 mol
O2 (g) : 0,02 mol
|
|
transformation chimique

|
EF (T,P)
CO2 (g)
: 0,02 mol
C (s) : 0,08 mol |
|
|
remarque : |
si tous les réactifs sont entièrement
consommés à la fin de la transformation, c'est qu'ils
étaient en proportions stúchiométriques.
ex. : |
équation
chimique |
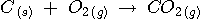
|
état
initial (en mol) |
0,02 |
0,02 |
0 |
état
intermédiaire (en mol) |
0,02
- x |
0,02
- x |
x |
état
final (en mol) |
0 |
0 |
0,02 |
|
|
2. Généralisation
ex. : |
on reprend les résultats
du TP de chimie, et on complète :
équation chimique |
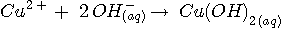
|
état initial (en
mol) |
0,005 |
... |
0 |
état intermédiaire
(en mol) |
0,005 -
x |
... - 2x |
x |
état final (en
mol) |
... |
... |
... |
L'avancement maximal correspond à la plus petite valeur de
x qui
satisfait
à la fois :
0,005 -
x  0 0
et
... -
2x 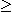 0 0 |
soit |
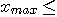 0,005 0,005
et

|
Le facteur limitant est ... / Les réactifs
étaient en proportions stúchiométrique.
|
Dans le cas général d'une équation chimique de la forme
: 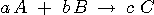 , on peut écrire :
, on peut écrire :
équation chimique |
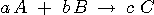
|
état initial (en mol) |
nA |
nB |
0 |
état intermédiaire (en
mol) |
nA - a.x |
nB - b.x |
c.x |
L'avancement maximal correspond à la plus petite valeur de x qui satisfait à la fois
:
nA - a.x  0 0
et
nB - b.x  0 0 |
soit |

et

|
Les réactifs sont dans les proportions stúchiométriques
si :
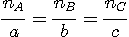 (car c.xmax = nC )
(car c.xmax = nC )
ex. :
|
pour le TP , on peut calculer (avec
nA
= 0,005 mol ) :
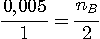
|
d'où |
nB = 0,010 mol pour 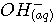
et xmax
= 0,005 mol |
|



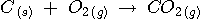
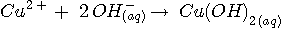
 0
0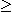 0
0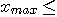 0,005
0,005
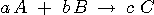 , on peut écrire :
, on peut écrire :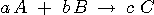
 0
0 0
0

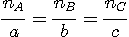 (car c.xmax = nC )
(car c.xmax = nC )