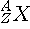
Un atome est formé d'une partie centrale, le noyau, entouré d'électrons (de charge
négative) en mouvement.
Le noyau est lui-même constitué de nucléons : les protons (de charge positive) et les neutrons (pas de charge électrique).
Si on représente l'atome par une sphère, son
rayon est de l'ordre de 10-10
m .
Si on représente également son noyau par une sphère, son
rayon est de l'ordre de 10-15
m , soit 100 000 fois plus petit : comme l'Univers, l'atome est essentiellement
constitué de vide.
Le nombre de charge Z est égal au nombre de protons du noyau ; il est caractéristique
de l'atome considéré.
Le nombre de nucléons A est égal au nombre total de protons et de neutrons du noyau.
remarques : |
|
On note de la manière suivante le symbole X d'un atome donné,
complété par les nombres Z et A :
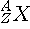
L'unité de charge est le coulomb (symbole : C ).
On appelle charge élémentaire la plus petite charge électrique que peut porter une particule
; elle a pour valeur :
e = + 1,6 . 10-19 C |
particule |
charge |
proton |
+ 1,6 . 10-19 C noté + e |
neutron |
0 C |
électron |
-1,6 . 10-19 C noté - e |
Un atome est électriquement
neutre : le nombre d'électrons est donc égal au nombre de protons.
La masse d'un atome est égale à la somme des
masses de toutes les particules qui le composent :
particule |
masse |
proton |
1,673 . 10-27 kg |
neutron |
1,675 . 10-27 kg |
électron |
9,109 . 10-31 kg |
remarques : |
|
La masse d'un atome est essentiellement concentrée dans son noyau : on
calculera donc en général la masse d'un atome en négligeant
celle des électrons.