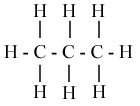 )
)
Les électrons d'un atome (ou d'un ion) se répartissent autour du noyau en couches successives.
Chaque couche est caractérisée par une lettre majuscule :
On considère que les couches sont remplies lorsqu'elles comportent :
Une couche commence à se remplir seulement si les précédentes
sont pleines (règle valable jusqu'au dix-huitième élément).
ex. : l'atome de sodium possède
11 électrons ; sa structure électronique est notée (K)2 (L)8 (M)1
La dernière couche occupée est la couche externe (ou couche périphérique) : elle joue un rôle important dans le comportement chimique des atomes.
remarque : les autres couches électroniques sont appelées des couches internes.
Les atomes des gaz nobles (He, Ne, Ar pour Z < 18) possèdent une couche externe avec 2 ou 8 électrons et restent en général isolés : ils sont stables.
Les autres atomes cherchent à acquérir la même structure électronique que le gaz noble de numéro atomique le plus proche :
Pour les atomes dont le numéro atomique est proche
de celui de l'hélium, la structure électronique recherchée
est un duet,
constitué de deux électrons.
Pour les autres, la structure électronique externe recherchée
est un octet,
constitué de huit électrons.
ex. : |
|
|||||||||||||||||||||||||||||
Une molécule est une association d'atomes ; elle est électriquement neutre.
Dans les molécules, les atomes mettent en commun des électrons en respectant, si possible, les règles du duet et de l'octet.
Une liaison covalente
simple est une mise en commun de deux électrons
entre deux atomes, chaque atome fournissant normalement un électron.
Le doublet d'électrons mis en commun est appelé doublet liant et forme une liaison
covalente entre les deux atomes concernés ; on le représente par
un tiret : A -
B (représentation de Lewis)
Une liaison covalente
double est une mise en commun de quatre électrons
entre deux atomes, chaque
atome fournissant normalement deux électrons.
Une liaison covalente
triple est une mise en commun de six électrons
entre deux atomes, chaque
atome fournissant normalement trois électrons.
Les électrons mis en commun appartiennent à chacun des deux atomes et doivent être pris en compte dans le total des électrons de chaque atome.
Les électrons (appartenant aux couches externes) d'un atome, qui ne participent pas aux liaisons covalentes, restent sur cet atome et sont répartis en doublets d'électrons appelés doublet non liant ; on les représente par un tiret placé sur (ou à côté de) l'atome considéré : A - B- (représentation de Lewis)
On peut noter la formule d'une molécule de plusieurs manières :
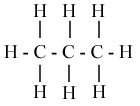 )
)
Des molécules ayant la même formule brute mais des formules développées différentes sont appelées des isomères.
ex. : à la formule brute C4H10 correspondent deux isomères
|
|
butane |
2-méthylpropoane |
remarque : |
les isomères ont des propriétés physiques et chimiques différentes et constituent des espèces chimiques distinctes. |
Des charges de même signe se repoussent : les doublets liants et non liants d'un atome se répartissent donc de manière à minimiser ces répulsions.
Dans le cas d'un atome possédants quatre doublets, ceux-ci adoptent une disposition tétraédrique.
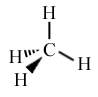
La représentation de Cram permet de rendre compte de la géométrie d'une molécule en adoptant les conventions suivantes :
![]() liaison dans le plan de l'écriture
liaison dans le plan de l'écriture
![]() liaison en avant du plan de l'écriture
liaison en avant du plan de l'écriture
![]() liaison en arrière du plan de l'écriture
liaison en arrière du plan de l'écriture
ex. : représentation de Cram de la molécule de méthane